یادگیری

همان گونه که مستحضرید اهمیت علم روان شناسی درکشورمان به صورت مدرن آن در چند دهه ی اخیر، بیش از پیش آشکار شده است.
به عبارت دیگر می توان گفت برای حل قسمت عمده ای از مسائلی که بشر امروز با آن روبرو است باید از علم روانشناسی کمک گرفت.
در همین راستا کتاب روان شناسی سال سوم رشته ادبیات و علوم انسانی بیش از یک دهه است که در چرخه ی آموزش کشور قرار دارد. مرکز یادگیری تبیان نیز به منظور یاری رساندن به شما دانش آموزان و دانشجویان عزیز، سلسله مقالاتی را در این ارتباط در نظر گرفته، که امید است مورد بهره مندیتان قرار گیرد.
برای یادگیری تعاریف متفاوتی بیان شده است. مثلا: یادگیری یعنی تغییر نسبتا دایمی رفتار که در اثر تجربه حاصل می شود.
بنابر این تعریف تغییرات رفتار در اثر رشد یا تغییرات فیزیولوژیک یادگیری محسوب نمی شوند، فرضا وقتی کودک به یک سالگی می رسد، تغییراتی از نظر قد و وزن پیدا می کند یا وقتی در تاریکی قرار می گیریم تغییراتی در دستگاه بینایی ما به وجود می آید، اما هیچ یک از این دو، یادگیری به حساب نمی آید.

غیر از بازتاب های طبیعی، تقریبا همه رفتارهای انسان تحت تأثیر یادگیری است، اما در مورد حیوانات این طورنیست، رفتار حیوانات تا اندازه ی زیادی غریزی یا ذاتی ست.
ماهی ها وقتی به دنیا می آیند شناکردن می دانند. سارها به طور غریزی می دانند که چگونه آواز بخوانند و چگونه لانه درست کنند. اما تنوع و پیچیدگی رفتار انسان اصولا نتیجه یادگیری از راه تجربه است.
تجربه برای یادگیری راه رفتن، حرف زدن به زبان مادری و محیط، جنبه بنیادی دارد. ما خواندن، محاسبه کردن، و استفاده ی سمبلیک ازتصاویر هندسی را می آموزیم. یاد می گیریم که وقتی گرسنه هستیم به دنبال غذایی برویم که در فرهنگ ما پذیرفته شده است. نوع غذایی را که انتخاب می کنیم، به ارث نبرده ایم، بلکه به مرور یاد گرفته ایم. رفتار هایی که از نظر اجتماع قابل پذیرش یا غیر قابل پذیریش هستند، یاد می گیریم.
یکی از جنبه های یادگیری، شرطی شدن است.
شرطی شدن یعنی بین دو رویداد ارتباط برقرار کردن، به نحوی که وقتی یکی ظاهر شد، دیگری نیز ظاهر شود. برای نمونه مسلما در رانندگی دیدن چراغ قرمز می ایستیم نه چراغ سبز.
این دانش را که با دیدن چراغ قرمز توقف کنیم، بدو تولد نداشتیم. در واقع ما معنای این علایم را یاد گرفته ایم. چون آن ها با سایر رویداد همراه شده اند، یعنی رعایت قانون ترمز با قرمز شدن چراغ باعث جلوگیری از تصادفات رانندگی و جریمه شدن، شده است، ما آن را انجام می دهیم.
ایوان پاولف فیزیولوژیست روسی اولین کسی بود که این نوع یادگیری، یعنی ایجاد پیوند بین رویداد ها را مورد مطالعه قرار داد.
او در جریان تحقیقات خود روی سگ ها کشف کرد که حیوانات نیز می توانند بین رویداد ها ارتباط برقرار کنند. در آزمایشات پاولف وقتی گوشت در دهان سگ قرار می گرفت، حیوان بر اساس ساخت زیستی خود، بزاق تراوش می کرد. ترشح بزاق در برابر گوشت، یک پاسخ طبیعی یا غیر اکتسابی یا غیر شرطی است که بازتاب نامیده می شود.
در این جا گوشت محرک نامیده می شود، یعنی عاملی که موجب واکنش ارگانیسم می گردد.
پاولف نشان داد که بازتاب ها نیز در اثر ارتباط، آموخته یا شرطی می شوند. مثلا صدای سینی غذا، حتی صدای پای دستیار آزمایشگاه، باعث ترشح بزاق حیوان می شد. در واقع یاد گرفته بود.
پاولف این نوع پاسخ های بزاقی را بازتاب های شرطی نامید. این بازتاب ها به شرطی ایجاد می شوند که محرک خنثی مثلا در اینجا، صدای سینی غذا و محرک غیر خنثی که در این جا خود غذاست، _و به طور طبیعی پاسخ ترشح بزاق را ایجاد می کند_ بار ها با یکدیگر همراه شوند.
امروزه بازتاب های شرطی را معمولا پاسخ های شرطی می نامند. بنابراین پاسخ شرطی، آموخته می شوند.
پاولف آزمایش خود را با کمی تفاوت چند بار تکرار کرد. بدین ترتیب که مدت کوتاهی پیش از دادن غذا به حیوان، زنگی را به صدا در آورد. پس از چند بار تکرار، سگ در مقابل صدای زنگ نیز براق ترشح می کرد، چون بین صدای زنگ و به دنبال آن، غذا ارتباط برقرار کرده بود. و در واقع شرطی شده بود.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اوربیتال مولکولی 1
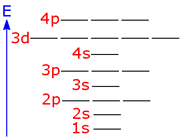
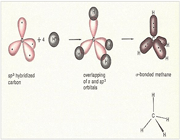
هنگام ایجاد یک پیوند بین دو اتم، اوربیتالهای اتمی آن ها با یکدیگر همپوشانی کرده و اوربیتالهای مولکولی را پدید میآورند. در این اوربیتالها، الکترونها در یک محیط مولکولی تحت تاثیر دو هسته قرار دارند و بر حسب قاعده آفبا در این اوربیتالها چیده میشوند.
اوربیتالهای مولکولی را با توجه به این که از همپوشانی کدام اوربیتال اتمی پدید آمده باشند،باحروف یونانی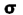 (سیگما) و
(سیگما) و 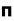 (پی) نمایش میدهند.
(پی) نمایش میدهند.
هنگام تشکیل یک پیوند، دو اوربیتال مولکولی حاصل میشود که با توجه به سطح انرژی، نسبت به اوربیتالهای اتمی به اوربیتالهای مولکولی پیوندی و ضد پیوندی شهرت دارند. به همان اندازه که اوربیتال مولکولی پیوندی، مولکول را پایدار میکند، اوربیتال مولکولی ضد پیوندی باعث ناپایداری پیوندی میشود.
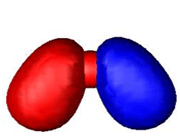
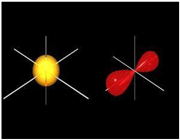
اوربیتال پیوندی
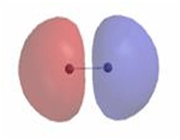
اوربیتال ضد پیوندی
با توجه به نارسایی های نظریه پیوند ظرفیت، هوندا در سال 1928 و مولیکن در سال 1931 نظریه دیگری بر اساس مدل موج اتم در مورد چگونگی تشکیل پیوند کووالانسی ارائه دادند که نظریه اوربیتال مولکولی نام گرفته است و به کمک آن بسیاری از خواص مغناطیسی، ترازهای انرژی، خواص طیفی و ... را به روشنی میتوان توجیه کرد.
در این نظریه برعکس نظریه پیوند (که فقط دخالت لایه ظرفیت اتمها را در تشکیل پیوند در نظر میگیرد) تمام اوربیتال های اتم میتواند در تشکیل اوربیتال های مولکولی شرکت داشته باشد و این اوربیتال ها بین چندین اتم و حتی در سراسر مولکول گسترده یا غیر مستقرند.
علاوه بر اوربیتال های پیوندی و غیر پیوندی، اوربیتال های ضد پیوندی نیز در تشکیل پیوند و توجیه پایداری و یا ناپایداری مولکول در نظر گرفته میشود و به تعداد اوربیتال های اتمی شرکت کننده، اوربیتال های مولکول تشکیل میشود.
شرایط همپوشانی اوربیتال ها
برای اینکه اوربیتال های اتمی بتوانند در حد تشکیل پیوند با یکدیگر همپوشانی کنند، باید دو شرط زیر درباره آن ها برقرار باشد:
فقط اوربیتال هایی میتوانند با یکدیگر همپوشانی کنند که، دریک سطح انرژی قرار داشته و یا سطوح انرژی آن ها به اندازه کافی به یکدیگر نزدیک باشد.
مثلا اوربیتال 3P یک اتم کلر می تواند فقط با اوربیتال 3P اتم دیگر کلر همپوشانی کند. اوربیتال S اتم H نمیتواند با اوربیتال 1S یا 2S و … اتم کلر همپوشانی کند، زیرا در سطح انرژی بالاتری نسبت به آنها قرار دارد.
فقط اوربیتال هایی میتوانند با یکدیگر همپوشانی کنند که نسبت به محور اصلی مولکول تقارن یکسانی داشته باشند. از این رو، مثلاً اوربیتال S که تقارن کروی دارد، در تشکیل مولکول های خطی میتواند با اوربیتال 2P که نسبت به محور اصلی مولکولی (محور Z) تقارن کامل دارد همپوشانی داشته باشد.
انواع اوربیتال های مولکولی
اوربیتال مولکولی پیوندی
اوربیتال مولکولی پیوندی اوربیتال مولکولی است که در آن چگالی در ناحیه بین هستهها زیاد است. انرژی دو الکترون که در اوربیتال مولکولی پیوندی قرار میگیرند، کمتر از هنگامی است که در اوربیتال های اتمی به وجود آورنده آن، قرار گرفته باشند.
اوربیتال مولکولی ضد پیوندی
اوربیتال مولکولی ضد پیوندی اوربیتال مولکولی است که در آن چگالی الکترونی در ناحیه بین هستهها کم است. انرژی دو الکترون که در اوربیتال مولکولی ضد پیوندی قرار میگیرند، بیشتر از هنگامی است که در اوربیتال های اتمی به وجود آورنده آن، قرار گرفته باشند.
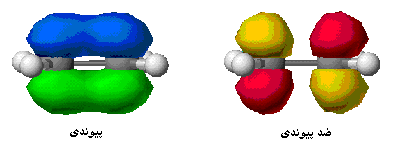
هر گاه دو اتم نتوانند به طریقی به هم نزدیک شوند که امکان همپوشانی اوربیتال های آن ها به وجود آید، همپوشانی اوربیتال ها صورت نمیگیرد و در نتیجه اوربیتال های اتمی به صورت غیر پیوندی در مولکول باقی خواهند ماند. اوربیتال های مولکولی را نیز با حروف یونانی 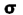 (سیگما) ،
(سیگما) ، 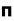 (پی) و ... نشانه گذاری میکنند.
(پی) و ... نشانه گذاری میکنند.
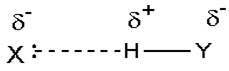
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اوربیتال مولکولی 2
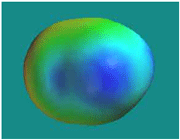
اوربیتال های مولکولی سیگما
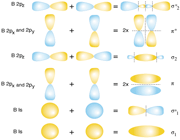
اگر تشکیل یک مولکول دو اتمی را از طریق نزدیک شدن اتم ها در امتداد یکی از محورها مثلاً x به صورت خطی در نظر بگیریم، دو اوربیتال اتمی (مثلا 1S) به یکدیگر نزدیک میشوند و در نتیجه همپوشانی، دو اوربیتال مولکولی پیوندی سیگما و ضد پیوندی سیگما را به وجود میآورند. تمام اوربیتال های سیگما، نسبت به محور بین دو هسته کاملا متقارنند و چرخش مولکول به دور این محور ، تغییر قابل مشاهدهای در شکل اوربیتال بوجود نمیآورد.
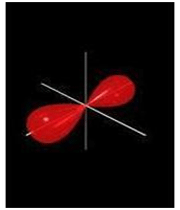
نمودار تراز انرژی تشکیل اوربیتال های مولکولی 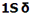 و
و 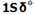 از اوربیتال های اتمی 1S دو اتم به شکل زیر میباشد:
از اوربیتال های اتمی 1S دو اتم به شکل زیر میباشد:
هر اوربیتال مولکولی میتواند دو الکترون با اسپین مخالف را در خود جای دهد. در مولکول هیدروژن، دو الکترون (با اسپین های جفت شده) اوربیتال 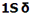 را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتالهای
را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتالهای 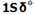
را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتال 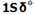 اشغال نشده است. تعداد پیوند (مرتبه پیوند)، در هر مولکول عبارت است از نصف تفاضل الکترونهای ضد پیوندی از الکترونهای پیوندی.
اشغال نشده است. تعداد پیوند (مرتبه پیوند)، در هر مولکول عبارت است از نصف تفاضل الکترونهای ضد پیوندی از الکترونهای پیوندی.
برای H2 داریم:
1=2/(0-2) = مرتبه پیوند
در مورد ترکیب دو اتم هلیوم، باید مجموع چهار الکترون در دو اوربیتال مولکولی جای داده شوند. با جای دادن دو الکترون در اوربیتال 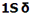 دو الکترون دیگر ناگزیر
دو الکترون دیگر ناگزیر 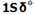 را اشغال میکنند. از این رو مرتبه پیوند مولکول فرضی He2 عبارتست از:
را اشغال میکنند. از این رو مرتبه پیوند مولکول فرضی He2 عبارتست از:
0=(2-2)1/2=مرتبه پیوند
لذا هلیوم به صورت مولکولی He2 نمیتواند وجود داشته باشد. اثر جدا کننده الکترون های ضد پیوندی، اثر اتصال دهنده الکترون های پیوندی را خنثی می کند. شواهدی در دست است که نشان می دهد یون های مولکولی+ H2 و + He2 می توانند در شرایط ویژه ای وجود داشته باشند. ترکیب دو اوربیتال 2S ، اوربیتال های مولکولی و 2*S خ´ را بوجود میآورند که با اوربیتال های 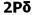 و
و 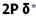 ناشی از ترکیب دو اوربیتال 1S مشابهند.
ناشی از ترکیب دو اوربیتال 1S مشابهند.

اما اوربیتال های مولکولی حاصل از ترکیب اوربیتال های اتمی 2P کمی پیچیدهترند. سه اوربیتال 2P هر اتم، در محورهای مختصات دکارتی z ، y ، x قرار دارند. اگر تشکیل یک مولکول دو اتمی از طریق نزدیک شدن سر به سر دو اوربیتال اتمی ( و یا ) صورت گیرد، در نتیجه همپوشانی، دو اوربیتال مولکولی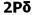 و
و 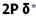 را بوجود میآورند .
را بوجود میآورند .
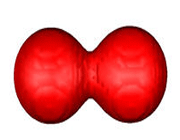
اوربیتال های مولکولی پی
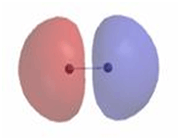
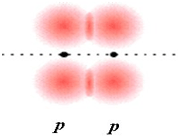
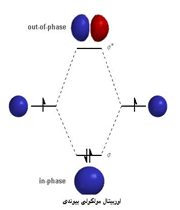
اگر در تشکیل یک مولکول دو اتمی، دو اوربیتال اتمی (مثلا PZ) از پهلو بهم نزدیک شوند، دو اوربیتال مولکولی، یکی اوربیتال مولکولی پیوندی پی و دیگری اوربیتال مولکولی ضد پیوندی پی ستاره را بوجود میآورند.

اوربیتال های پای نسبت به محور بین دو هسته تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال P از پهلو، به تشکیل اوربیتال پای میانجامد، که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند. در هر حال اثر نهایی اوربیتال پای ، بهم نگهداشتن مولکول است. اوربیتال پای ستاره ، در ناحیه بین دو هسته، چگالی الکترونی کمی دارد. اثر نهایی مولکول پای ستاره جدا کردن دو اتم از یکدیگر است.
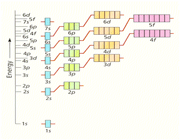
سطح انرژی اوربیتالهای مولکولی
انرژی یک اوربیتال مولکولی به انرژی اوربیتالهای اتمی تشکیل دهنده آن و همچنین به انرژی اوربیتالهای اتمی تشکیل دهنده آن و همچنین به میزان و نوع همپوشانی اوربیتالهای اتمی که در تشکیل آن صورت میگیرد، بستگی دارد. به این ترتیب، انرژی هر دو اوربیتال مولکولی 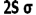 و
و 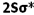 پایین تر از انرژی هر اوربیتال مولکولی است که اوربیتال های اتمی 2Pحاصل می شود. انرژی اوربیتال های
پایین تر از انرژی هر اوربیتال مولکولی است که اوربیتال های اتمی 2Pحاصل می شود. انرژی اوربیتال های 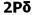 و
و 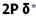 پایین تر از انرژی هر یک از دو اوربیتال
پایین تر از انرژی هر یک از دو اوربیتال 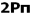 می باشد. زیرا میزان همپوشانی اوربیتال های 2PX بیشتر از میزان همپوشانی 2PY و 2PZ می باشد.
می باشد. زیرا میزان همپوشانی اوربیتال های 2PX بیشتر از میزان همپوشانی 2PY و 2PZ می باشد.
در مولکولهایی که اوربیتالهای مولکولی 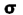 از همپوشانی بین یک اوربیتال Px و s حاصل میشود (تاثیر متقابل s-p)، این همپوشانی اضافی پیوند
از همپوشانی بین یک اوربیتال Px و s حاصل میشود (تاثیر متقابل s-p)، این همپوشانی اضافی پیوند 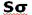 به ازای تضعیف پیوند
به ازای تضعیف پیوند 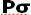 ، تقویت میشود و همچنین تاثیر متقابل s-p باعث کاهش انرژی اوربیتال
، تقویت میشود و همچنین تاثیر متقابل s-p باعث کاهش انرژی اوربیتال 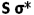 و افزایش انرژی
و افزایش انرژی 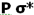 میشود. بنابراین سطح انرژی
میشود. بنابراین سطح انرژی 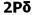 برای مولکولهای جور هسته متشکل از عناصر گروه دوم (به جز O2 و F2 ) پایین تر از سطح انرژی
برای مولکولهای جور هسته متشکل از عناصر گروه دوم (به جز O2 و F2 ) پایین تر از سطح انرژی 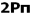 میباشد. البته تاثیر متقابل s-p به میزان نزدیک تر انرژی اوربیتالهای p و s بستگی دارد. اگر تفاوت انرژی این دو اوربیتال خیلی زیاد باشد (مثل O2 و F2 ) این تاثیر اضافی مساله بوجود نمی آورد.
میباشد. البته تاثیر متقابل s-p به میزان نزدیک تر انرژی اوربیتالهای p و s بستگی دارد. اگر تفاوت انرژی این دو اوربیتال خیلی زیاد باشد (مثل O2 و F2 ) این تاثیر اضافی مساله بوجود نمی آورد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
الکترونگاتیویته 1
الکترونگاتیویته میزان توانایی نسبی یک اتم در یک مولکول برای جذب جفت الکترون پیوندی به سوی خود است.
مقیاس نسبی پاولینگ
مقیاس نسبی الکترونگاتیوی پاولینگ، متداول ترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوندی است. مقدار انرژی اضافی که از جاذبه متقابل بارهای جزئی 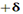 و
و 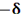 اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق
اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق 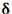 و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد.
و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد.
در محاسبات الکترونگاتیوی تنها تفاوت الکترونگاتیویته عناصر تعیین میشود. برای بنا کردن یک مقیاس ، به اتم F (الکترونگاتیوترین عنصر) بطور دلخواه عدد 4 نسبت داده شده است.
مقیاس الکترونگاتیوی پائولینگ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژی های پیوند است. مثلا انرژی پیوند Br-Br ،انرژی لازم برای تفکیک مولکول Br2 به اتم های Br است. برای تفکیک یک مول از مولکول های Br2 به اندازه 46+ کیلو کالری انرژی لازم است. انرژی پیوند H-H برابر 104+ کیلو کالری بر مول است.

الکترونگاتیویته به روش های متفاوتی تعریف شده است که برخی از آن ها به اختصار توضیح داده می شود.
الکترونگاتیویته پاولینگ
انرژی اضافی پیوند A-B نسبت به متوسط انرژی پیوندهای A-A و B-B می تواندبه حضور سهم یونی در پیوند کوالانسی نسبت داده شود. اگر انرژی پیوند A-B به طور قابل ملاحطه ای از متوسط پیوندهای غیر قطبی A-A و B-B متفاوت باشد میتوان فرض کرد که سهم یونی در تابع موج و بنابراین اختلاف بزرگ در الکترونگاتیوی وجود دارد.
الکترونگاتیویته آلرد - روکر
در این تعریف الکترونگاتیویته توسط میدان الکتریکی بر سطح اتم مشخص میشود. بنابرین الکترون در یک اتم بار موثر هستهای را احساس می کند. بر طبق این تعریف عناصری با الکترونگاتیویته بالا آن هایی هستند با بار هستهای موثر بزرگ و شعاع کوالانسی کوچک این عناصر در نزدیکی فلوئور قرار دارند.
الکترونگاتیویته مولیکن
مولیکن تعریف خود را بر پایه دادههای طیفهای اتمی نهاد. او فرض کرد که توریع دوباره الکترون در طی تشکیل ترکیب به گونهای است که در آن یک اتم به کاتیون (توسط ار دست دادن الکترون) و اتم دیگر به آنیون (توسط گرفتن الکترون) تبدیل میشود.
طیف هیدروژن
از طرف دیگر
این مشاهدات تعریف مولیکن را به عنوان مقدار متوسط انرژی یونش و الکترونخواهی عنصر معرفی می کند.
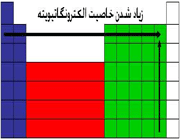
تغییرات الکترونگاتیویته عناصر
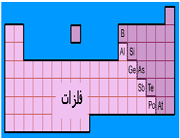
الکترونگاتیویته عناصر با افزایش تعداد الکترونهای والانس و هم چنین کاهش اندازه اتم افزایش مییابد و در هر دوره از جدول تناوبی از چپ به راست و در هر گروه از پایین به بالا افزایش مییابد.
فلزات، جاذبه کمی برای الکترونهای والانس دارند و الکترونگاتیوی آن ها حاکم است، ولی نا فلزات، به استثنای گازهای نجیب، جاذبه قوی برای اینگونه الکترونها دارند و الکترونگاتیوی آن ها زیاد است.
بنابراین، الکترونگاتیوترین عناصر، در گوشه بالایی سمت راست جدول تناوبی (بدون در نظر گرفتن گازهای نجیب) و عناصری که کمترین الکترونگاتیوی را دارند، در گوشه پایینی سمت چپ این جدول قرار دارند. این سیر تغییرات، با سیر تغییرات پتانسیل یونش و الکترونخواهی عناصر در جدول تناوبی هم جهت است
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
الکترونگاتیویته 2
مفهوم الکترونگاتیوی
مفهوم الکترونگاتیوی گرچه مفید است ولی دقیق نیست. روشی ساده و مستقیم برای اندازه گیری خاصیت الکترونگاتیویته وجود ندارد و روش های گوناگون برای اندازه گیری آن پیشنهاد شده است. در واقع چون این خاصیت علاوه بر ساختمان اتم مورد نظر به تعداد و ماهیت اتم های متصل به آن نیز بستگی دارد، الکترونگاتیوی یک اتم متغیر است. انتظار می رود که الکترونگاتیوی فسفر در PCl3 با الکترونگاتیوی آن در PCl5 تفاوت داشته باشد. از این رو این مفهوم را تنها بایستی نیمه کمی تلقی کرد.
PCl5

PCl3
بنابراین میتوان گفت که قطبی بودن مولکول HCl ناشی از اختلاف بین الکترونگاتیوی کلر و هیدروژن است چون کلر الکترونگاتیوتر از هیدروژن است، آن سر مولکول که به کلر منتهی می شود، سر منفی دو قطبی است.
توجیه پیوند یونی با خاصیت الکترونگاتیویته
پیوند یونی بین غیرفلزات وقتی تشکیل میشود که اختلاف الکترونگاتیوی آن ها خیلی زیاد نباشد. در این گونه موارد اختلاف الکترونگاتیوی عناصر، نشان دهنده میزان قطبی بودن پیوندهای کووالانسی است.
هر چقدر اختلاف الکترونگاتیوی بیشتر باشد پیوند کووالانسی قطبیتر خوهد بود (پیوند در جهت اتم الکترونگاتیوتر قطبی میشود). بنابراین با توجه به مقادیر الکترونگاتیوی میتوان پیشگویی کرد که (HF) قطبیترین هیدروژن هالیدها است و انرژی پیوندی آن بیشتر از هر یک از این ترکیبات است. البته نوع پیوندی که بین دو فلز تشکیل می شود (پیوند فلزی) و در آن اختلاف الکترونگاتیوی نسبتا کم است.
مقدار الکترونگاتیوی HF
کاربردهای الکترو نگاتیویته
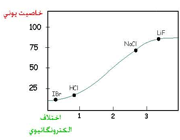
هرچه اختلاف الکترونگاتیوی دو عنصر بیشتر باشد، پیوند بین آنها قطبیتر خواهد بود. هرگاه اختلاف الکترونگاتیوی دو عنصر در حدود 7/1 باشد. خصلت یونی نسبی پیوند بیش از 50% است.
3. اگر اختلاف الکترونگاتیوی صفر و یا خیلی کوچک باشد، پیوند غیر قطبی است. هرچه اختلاف الکترونگاتیوی بیشتر باشد، پیوند کووالانسی قطبیتر خواهد بود. در این پیوندها، اتمی که الکترونگاتیوی بیشتری دارد، بار منفی جزئی را خواهد داشت.
4. با استفاده از مقادیر الکترونگاتیوی میتوان نوع پیوندی را که یک ترکیب ممکن است داشته باشد، پیشبینی کرد. وقتی دو عنصر با اختلاف الکترونگاتیوی زیاد با یکدیگر ترکیب می شوند، یک ترکیب یونی حاصل میشود. مثلا اختلاف الکترونگاتیوی سدیم و کلر 1/2 است و NaCl یک ترکیب یونی است.
آیا الکترونگاتیوی یک عنصر همیشه ثابت است؟
بنابراین الکترونگاتیوی یک عنصر همیشه ثابت نیست مثلا الکترونگاتیوی فسفر در ترکیب (PCl3) متفاوت از الکترونگاتیوی آن در ترکیب (PCl5) است.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
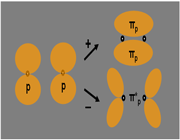
پیوند پای
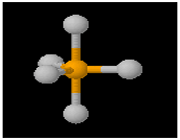
اوربیتالهای مولکولی حاصل از ترکیب اوربیتالهای اتمی (2P)، کمی پیچیدهاند. سه اوربیتال (2P) هر اتم، در امتداد محورهای مختصات دکارتی (X ، Y ، Z ) قرار دارند. اگر تشکیل یک مولکول دو اتمی را از طریق نزدیک شدن اتم ها در امتداد یکی از این محورها مثلاً (X) در نظر بگیریم، دو اوربیتال اتمی (Px) سر به سر به یکدیگر نزدیک میشوند و در نتیجه همپوشانی، دو اوربیتال مولکولی پیوندی 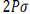 و ضد پیوندی
و ضد پیوندی 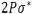 را به وجود میآورند.
را به وجود میآورند.
تعریف پیوند پی
پیوند کووالانسی که تراکم الکترونی آن در دو ناحیه بالا و پایین محور متصل کننده دو اتم پیوند بیشتر است، پیوند پی ( 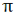 ) نامیده میشود.
) نامیده میشود.
اوربیتال پیوندی مولکولی پی ( 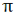 ) و ضد پیوندی (
) و ضد پیوندی ( 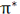 )
)
در تشکیل یک مولکول دو اتمی، دو اوربیتال اتمی (Pz) از پهلو به هم نزدیک میشوند و دو اوربیتال مولکولی، یکی اوربیتال پیوندی پی ( 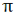 ) و دیگری اوربیتال مولکولی ضد پیوندی
) و دیگری اوربیتال مولکولی ضد پیوندی 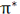 را به وجود میآورند.
را به وجود میآورند.
اوربیتالهای 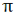 نسبت به محور بین دو هسته، تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال (P) از پهلو ، به تشکیل اوربیتال
نسبت به محور بین دو هسته، تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال (P) از پهلو ، به تشکیل اوربیتال 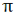 میانجامد که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند.
میانجامد که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند.
در هر حال اثر نهایی اوربیتال 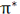 ، به هم نگه داشتن مولکول است. اوربیتال
، به هم نگه داشتن مولکول است. اوربیتال 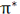 ، در ناحیه بین دو هسته، چگالی الکترونی کمی دارد. اثر نهایی اوربیتال
، در ناحیه بین دو هسته، چگالی الکترونی کمی دارد. اثر نهایی اوربیتال 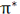 جدا کردن دو اتم از یکدیگر است.
جدا کردن دو اتم از یکدیگر است.
اوربیتالهای اتمی (Py) نیز از پهلو به هم نزدیک میشوند. این دو اوربیتال اتمی نیز یک مجموعه ی دوتایی اوربیتال مولکولی 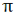 و
و 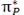 به وجود میآورند که نسبت به مجموعه اول عمود است.
به وجود میآورند که نسبت به مجموعه اول عمود است.
انرژی اوربیتالهای 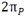 و
و 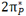
دو اوربیتال 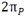 با یکدیگر و دو اوربیتال
با یکدیگر و دو اوربیتال 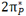 با یکدیگر هم انرژی هستند. بنابراین شش اوربیتال مولکولی از دو مجموعه سه تایی P به وجود میآید یک اوربیتال
با یکدیگر هم انرژی هستند. بنابراین شش اوربیتال مولکولی از دو مجموعه سه تایی P به وجود میآید یک اوربیتال 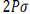 ، یک اوربیتال
، یک اوربیتال 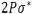 ، دو اوربیتال
، دو اوربیتال 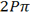 و دو اوربیتال
و دو اوربیتال  .
.
این شش اوربیتال به همراه دو اوربیتال از دو اوربیتال اتمی 2S ، مجموعا هشت اوربیتال مولکولی را تشکیل میدهند که از اوربیتالهای اتمی n=2 مربوط به دو اتم به دست میآیند.
تعریف انرژی اوربیتال مولکولی
انرژی یک اوربیتال مولکولی به موارد زیر بستگی دارد:
1. انرژی اوربیتالهای اتمی تشکیل دهنده آن
2. میزان و نوع همپوشانی اوربیتالهای اتمی در هنگام تشکیل آن
مقایسه انرژی 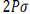 و
و 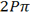
چون میزان همپوشانی اوربیتالهای 2P در تشکیل اوربیتال مولکولی 2P6 بیشتر از همپوشانی آن ها برای به وجود آوردن اوربیتال مولکولی 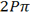 است، اوربیتال
است، اوربیتال 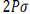 انرژی کمتری از دو اوربیتال مولکولی هم تراز
انرژی کمتری از دو اوربیتال مولکولی هم تراز 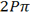 دارد.
دارد.
اوربیتالهای ضد پیوندی از هر نوع، همان قدر انرژی سیستم را افزایش می دهد که اوربیتال پیوندی از همان نوع، از انرژی سیستم میکاهد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اختلال های رفتاری

به عبارت دیگر می توان گفت برای حل قسمت عمده ای از مسائلی که بشر امروز با آن روبرو است باید از علم روانشناسی کمک گرفت.
در همین راستا کتاب روان شناسی سال سوم رشته ادبیات و علوم انسانی بیش از یک دهه است که در چرخه ی آموزش کشور قرار دارد. مرکز یادگیری تبیان نیز به منظور یاری رساندن به شما دانش آموزان و دانشجویان عزیز، سلسله مقالاتی را در این ارتباط در نظر گرفته، که امید است مورد بهره مندیتان قرار گیرد.
جای تردید نیست که هر دستگاهی ممکن است اختلال کند، مثل هواپیما، کامپیوتر و... و بالطبع لازم می شود که دوباره تعمیر شوند. دستگاه عصبی مرکزی (مخ، نخاع و اعصاب) نیز اختلال پیدا می کند و این اختلال د رفتار منعکس می شود.
حال این اختلال رفتاری یا نابهنجاری رفتاری چیست؟
همانند بیش تر مفاهیم مربوط به انسان و مفاهیم مربوط به روان شناسی، تعریف رفتار نابهنجار و تعیین مرز آن با رفتار بهنجار، کاری بسیار دشوار و شاید هم غیر ممکن است. از نظر روان شناسان انسان بهنجار فردی است که:

بنابراین تعریف، هر فردی، کم و بیش بیمار (کم و بیش نابهنجار) خواهد بود. اما در واقع کسی که به شدت نابهنجار باشد، به طوری که نظم زندگی خود و دیگران را به هم بزند، مبادرت به خودکشی کند و همیشه اضطراب داشته باشد، فرد نابهنجار یا بیمار به حساب خواهد آمد.
اما اگر کسی به شغل شرافتمندانه ای اشتغال داشته باشد، به فکر سعادت خود و خانواده اش باشد و به حقوق دیگران احترام بگذارد و هدف اجتماع پسندی را دنبال کند، اضطراب، نگرانی، افسردگی یا شادی او متناسب با موقعیت باشد، بهنجار یا سالم به حساب خواهد آمد.
اختلال های اضطرابی
اختلال های اضطرابی نشانه های ذهنی و جسمی دارند.
در میان نشانه های ذهنی می توان به ترس از بدبختی، ترس از کنترل نداشتن بر خود، ناتوانی در راحت بودن و رفع خستگی اشاره کرد.
نشانه ی جسمی اضطراب عبارت است: از فعالیت شدید شاخه ی سمپاتیک دستگاه عصبی خودکار که با لرزش، عرق، سرعت و شدت تپش های قلبی، بالا رفتن فشار خون (سرخ شدن چهره) و سرگیجه همراه است.
می توان گفت که اضطراب، یک واکنش مناسب در مقابل تهدید است. با این همه، اگر گستردگی آن از حدود تهدید فراتر رود یا به طور کامل غیر قابل انتظار باشد، نابهنجار به حساب خواهد آمد. اختلال های اضطرابی، موارد زیر را شامل می شوند:
فوبی ها یا ترس های مرضی،
اختلال های وحشت زدگی،
اضطراب فراگیر، اختلال وسواس فکری –عملی و
استرس پس- آسیبی.
اختلال های خلقی
اختلال های خلقی به اختلال هایی گفته می شود که با آشوب ها و دگرگونی های شدید هیجانی همراه هستند. آشوب های هیجانی معمولا از طریق افسردگی یا برانگیختگی بیش از اندازه منعکس می شوند.
البته نباید فراموش کرد که، در بیشتر مواقع، افسردگی و برانگیختگی عادی است، مثلا، اگر در امتحان مردود شویم خیلی طبیعی خواهد بود که احساس افسردگی کنیم، یا اگر یکی از نزدیکان خود را از دست بدهیم، به شدت افسرده خواهیم بود و این کاملا طبیعی است.
اضطراب و افسردگی زمانی اختلال به حساب می آیند که اغراق آمیز باشند. مثلا، چند سال پس از فوت یکی از عزیزان، همچنان افسرده باشیم.
افسردگی یکی از اختلال های روانی بسیار شایع است که آن را، از نظر روانی به ذکام تشبیه می کنند. اشخاصی که از افسردگی عادی رنج می برند، ممکن است احساس غم کنند و افکار مالیخولیایی داشته باشند. احتمال دارد که آن ها از کمبود انرژی، افت اعتماد به نفس، دشواری در تمرکز، عدم علاقه به دیگران و فعالیت های خوشایند، احساس بدبینی و تمایل به گریه کردن و افکار منجر به خودکشی رنج ببرند.
اشخاص مبتلا به افسردگی شدید نیز معمولا همه ی احساسات بالا را نشان می دهند، با این تفاوت که شدت احساسات آن ها به ظاهر خیلی شدید است. به علاوه، احتمال دارد که آن ها اشتها و مقداری از وزن خود را از دست بدهند، تمرکز نداشته باشند، به بی اعتنایی عمومی و تلاش برای خودکشی گرفتار شوند.
نقطه ی مقابل افسردگی، سرخوشی یا شیدایی است. افراد سرخوش یا مانیک، به شدت برانگیخته می شوند، حرکات ابلهانه انجام می دهند و اشیا و لوازم را تخریب می کنند. این افراد به طور تکانشی رفتار می کنند، تند حرف می زنند، تسلسل افکار دارند، از محدوده ی خود خارج می شوند، به طور انفحاری می خندند، روی پا بند نمی شوند، دیگران را مسخره می کنند و...
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
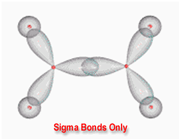
پیوند سیگما
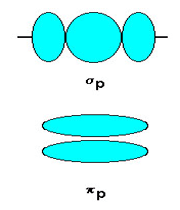
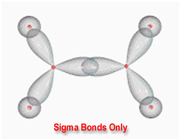
اوربیتال S به شکل کره است و مرکز آن در هسته اتم قرار دارد. برای تشکیل پیوند، دو هسته باید به اندازه کافی به یکدیگر نزدیک شوند تا همپوشانی مولکول های اوربیتالهای اتمی صورت پذیرد.
نشان دادن اوربیتالهای اتمی با حروف (P , S , ...) مرسوم است. اوبیتالهای مولکولی نیز با حروف یونانی (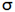 ) سیگما،
) سیگما،
(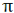 ) (پی) و غیره نشانه گذاری میشوند.
) (پی) و غیره نشانه گذاری میشوند.
تشکیل پیوند سیگما
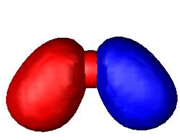
اوربیتالهای مولکولی (H2)، از همپوشانی دو اوربیتال (S) از دو اتم هیدروژن حاصل شدهاند. اگر همپوشانی طوری بین دو اوربیتال صورت پذیرد که ابر الکترونی بین دو هسته، همدیگر را تقویت کنند، چگالی الکترونی در ناحیه بین دو هسته زیاد خواهد بود و جاذبه دو هسته با بار مثبت نسبت به ابر الکترونی اضافه با بار منفی، مولکول را به هم نگه میدارد و مولکول پایدارتر از اتمهای هیدروژن میشود. اوربیتالهای پیوندی یا اوربیتال مولکولی حاصل، اوربیتالهای سیگما و این پیوندها را پیوندهای سیگما مینامند و با نماد (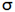 ) نشان داده میدهند.
) نشان داده میدهند.
تشکیل اوربیتال ضد پیوندی سیگما
چون دو اوربیتال اتمی با یکدیگر ترکیب شدهاند، باید دو اوربیتال مولکولی به دست آید. اوربیتال مولکولی دیگر، وقتی حاصل می شود که همپوشانی بین دو اروبیتال اتمی طوری صورت پذیرد که ابر الکترونی بین دو هسته، همدیگر را تضعیف کنند.
در این حالت چگالی الکترونی در ناحیه بین دو هسته خیلی کم است.
چون دو هسته ی مثبت همدیگر را دفع میکنند و در فاصله بین آن ها، چگالی کم الکترونی قادر به جبران این دافعه با ایجاد جاذبهای قوی نیست، لذا نزدیک نگاه داشتن دو هسته در این حالت نیازمند انرژی است. این اوربیتال مولکولی را اوربیتال ضد پیوندی سیگما ( با نشان 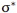 ) مینامند. چون نه تنها در به هم نگه داشتن دو اتم کمک نمیکند بلکه عمل آن در جهت دور کردن دو اتم از یکدیگر است.
) مینامند. چون نه تنها در به هم نگه داشتن دو اتم کمک نمیکند بلکه عمل آن در جهت دور کردن دو اتم از یکدیگر است.
تقارن اوربیتالهای سیگما
اوربیتالهای سیگما (پیوندی و غیرپیوندی)، به دور محوری که دو هسته را به یکدیگر متصل میکند، تقارن استوانهای دارند و چرخش مولکول دور این محور، تغییر قابل مشاهدهای در شکل اوربیتال به وجود نمیآورد.
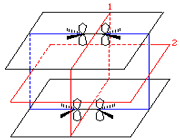
انرژی اوربیتال پیوندی سیگما از انرژی هر یک از اوبیتالهای اتمی که آن را به وجود آوردهاند کمتر است، در حالی که انرژی اوربیتال ضد پیوندی سیگما از انرژی هر یک از اوبیتالهای اتمی که آن را به وجود آوردهاند بالاتر است.
وقتی دو اوربیتال اتمی ترکیب میشوند:
اوربیتال مولکولی پیوندی نشان دهنده کاهش انرژی سیستم و اوربیتال مولکولی ضد پیوندی نشان دهنده افزایش انرژی سیستم است
مرتبه پیوند
هر اوربیتال ( اتمی یا مولکولی ) میتواند دو الکترون با اسپین مخالف را در خود جای دهد. در مولکول هیدروژن دو الکترون ( با اسپینهای جفت شده ) اوربیتال ( 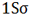 ) را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتال (
) را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتال (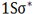 ) اشغال شده است.
) اشغال شده است.
تعداد پیوند یا مرتبه پیوند در هر مولکول عبارت است از نصف الکترون های ضد پیوندی از الکترون های پیوندی است.
مرتبه پیوند برای (H2) برابر 1 و برای (He) صفر است.
بررسی اوربیتال (2S)
ترکیب دو اوربیتال (2S)، اوربیتالهای مولکولی (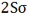 ) و (
) و ( 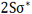 ) را به وجود میآورد که با اوربیتالهای (
) را به وجود میآورد که با اوربیتالهای (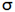 ) و (
) و ( 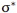 ) ناشی از ترکیب دو اوربیتال (1S) مشابه اند.
) ناشی از ترکیب دو اوربیتال (1S) مشابه اند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
پیوند فلزی
تعریف پیوند فلزی
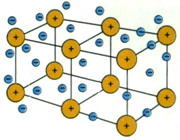
بین اتم های فلز در شبکه بلور پیوند ویژهای وجود دارد که در اصطلاح پیوند فلزی نامیده میشود.
توجیه پیوند فلزی
انرژی یونش فلزات نسبت به غیر فلزات نسبتا کمتر و تعداد اوربیتال های خالی لایه ظرفیت اتم آن ها نسبت به تعداد الکترون های لایه ظرفیت نیز کم است. از این رو، تعدادی از الکترون های سست لایه ظرفیت اتم فلز که در اصطلاح دریای الکترون فلزی نیز نامیده میشوند، باقیمانده اتم های فلز را که دارای بارمثبت خواهند بود، فرا میگیرد. جاذبه الکتروستاتیکی بین این ذرههای مثبت فلزی و بارمنفی توده ابر الکترونی آزاد فلزی به وجود می آید که سرتاسر شبکه بلور فلز را گرفته است.
پیوند فلزی
جاذبه الکتروستاتیکی حاصل بین ذرههای مثبت فلزی و بارمنفی توده ابر الکترونی آزاد، عامل پیوند بین ذرههای فلز محسوب میشود و اتصال ذرههای فلز را در شبکه و انسجام بلور فلزی را تأمین میکند. چون چنین پیوندی دارای جهت خاصی نیست و ذرههای فلز نیز امکان جابجا شدن در داخل توده ابر الکترون آزاد فلزی را در شبکه بلور دارند، از این رو، به روشنی میتوان بسیاری ازخواص ویژه مکانیکی فلزها، مانند قابلیت چکش خواری، مفتول شدن، تورق و غیره را توجیه کرد.
توجیه خواص فلزات با پیوند فلزی
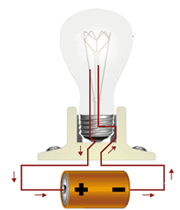
1. رسانایی الکتریکی
جریان برق نتیجه جابجایی الکترون است. وقتی دو سر سیم برق رابه یک تکه فلز متصل کنیم از قطب مثبت جریان تعدادی الکترون از فلز خارج میشود، این کمبود الکترونی بر الکترون های غیرمستقر در فلزات اثر گذاشته، آن ها را به سمت خود میکشند. این امر باعث میشود که همان تعداد الکترون که از یک طرف خارج شده بود از طرف دیگر وارد شود و به این وسیله جریان الکتریسته انتقال یابد.
2. رسانایی گرمایی
بر اثر گرم کردن فلز، جنبش الکترون های غیر مستقر افزایش مییابد و این جنبش از یک گوشه فلز به سایر قسمت های آن منتقل میشود.
3. درخشندگی و جلای فلزات
تابش نور به سطح فلز باعث میشود که الکترون های غیر مستقر در سطح فلز برانگیخته شده و به ترازهای بالاتر انرژی بروند. بازگشت این الکترون ها باعث میشود که امواج نور مرئی از سطح فلز بازتابیده شود. در مورد فلزات رنگین بازگشت الکترون ها تنها طول موج معینی را که مربوط به رنگ فلز است بازتاب میکند.
4. پدیدههای فوتوالکتریک و ترموالکتریک
وقتی انرژی کافی (نورانی یا گرمایی) به فلز داده شود برانگیخته شدن الکترون بدان حد میرسد که الکترون از فلز جدا شود. هرگاه دستگاه مناسبی فراهم کنیم میتوانیم الکنرون جدا شده را درمدار به جریان در آورده الکتریسته تولید کنیم.
5. چکش خواری
وقتی ضربهای به فلز وارد میشود یون های مثبت در دریای الکترون منفی جابجا میشوند ولی دریای بار منفی پیوستگی تکه فلز را حفظ میکند.
طول و شعاع پیوند فلزی
در مورد فلزها اصطلاح طول پیوند فلزی، به فاصله تعادلی بین هسته دو اتم مجاور در شبکه بلور فلزها اطلاق میشود. بر حسب قرار داد نصف طول پیوند فلزی را شعاع فلزی مینامند که گاهی شعاع اتمی فلز نیز نامیده میشود.
باید توجه داشت که شعاع فلزی به سیستم بلوری فلز وابستگی دارد. یعنی اگر فلزی در چند سیستم متمایز متبلور شود شعاع فلزی آن در سیستم های گوناگون یکسان نخواهد بود. بررسیها و محاسبهها نشان داده است که هرچقدر عدد کوئوردیناسیون اتم فلز در شبکه بلور بزرگ تر باشد طول شعاع فلزی آن افزایش می یابد.
با توجه به این که در پیوند فلزی بر خلاف پیوند کوالانسی همپوشانی بین اوربیتال های دو اتم صورت نمیگیرد، انتظار میرود که طول پیوند کوالانسی آن بیش تر باشد که تجربه نیز چنین رویدادی را تأیید میکند. بدیهی است که شعاع فلزی نیز از شعاع کوالانسی بزرگتر است.
شعاع اتمی فلز قلیایی در هر دوره نسبت به شعاع اتمی عنصرهای دیگر آن دوره به نسبت بزرگتر است
پس از فلزات قلیایی خاکی در هر دوره بویژه از دوره چهارم به بعد اندازه شعاع اتمی به شدت کاهش مییابد.
این کاهش شدید اندازه شعاع را باید از یک طرف به بالا بودن سطح تراز S لایه ظرفیت اتم عنصرهای قلیایی خاکی و قلیایی و پایین بودن سطح تراز d لایه ظرفیت فلزات واسطه و گسترده بودن اوربیتال های d در این عنصر مثبت داد. زیرا به دلیل عمقی و گسترده بودن اوربیتال های d، ابر بار الکترون ها در آن ها گسترده است و اثر پوششی ناچیزی در مقابل تأثیر بار هسته اتم برلایه خارجی اتم اعمال میکنند.
از این رو بر اثر بالا رفتن بیش ازحد انتظار مقدار بار مۆثر هسته اتم فلزهای واسطه اندازه شعاع آن ها به شدت کاهش مییابد.
روند تغییر اندازه شعاعها در مورد فلزهای واسطه هر دوره جالب توجه و برخلاف روند عادی آن در مورد تغییر شعاع عنصرهای اصلی در دوره هاست. البته این روند به وضعیت الکترونی ویژه آن ها بستگی دارد. با توجه به قابلیت انعطاف و تغییر شکل ناپذیری که نتیجه قابلیت تحرک پیوند فلزی است انتظار میرود که قدرت پیوند بین دو اتم فلز در بلور فلزی از قدرت پیوند کوالانسی بین دو اتم آن در حالت گازی کم تر باشد.
انرژی پیوند فلزی
اندازه گیری گرمای تفکیک نشان میدهد که انرژی مولی پیوند فلزی در شبکه بلوری از انرژی مولی تفکیک پیوند کوالانسی آن به صورت مولکول دو اتمی بیش تر است. این رویداد را این طور میتوان توجیه کرد که پیوند فلزی به تعداد نامحدود در تمام راستا در شبکه بلور فلزی تشکیل میشود در صورتی که چنین وضعیتی در حالت گازی فلزها وجود ندارد.
از این رو با وجود این که بلور فلزی پیوستگی و پایداری زیادی دارد و پیوند فلزی در مجموع پیوندی قوی محسوب میشود. بدیهی است در هر گروه با افزایش عدد اتمی و بزرگ تر شدن طول پیوند فلزی انرژی پیوند و گرمای تفکیک مولی فلز کاهش می یابد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
پیوند کووالانسی
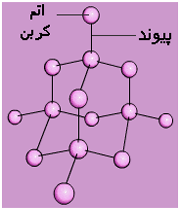
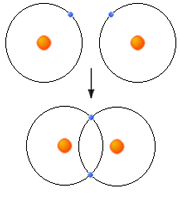
میلیونها ماده مرکب شناخته شده فقط از غیر فلزات ترکیب یافتهاند. این مواد مرکب فقط شامل عناصری هستند که در هر اتم 4 ، 5 ، 6 یا 7 الکترون والانس دارند. بنابراین الکترونهای والانس اتمهای غیر فلزی آنقدر زیاد است که اتمها نمیتوانند با از دست دادن آن ها ساختار یک گاز نجیب را به دست آورند. معمولا غیر فلزات با جفت کردن الکترونها پیوند ایجاد میکنند و در این فرآیند به ساختار یک گاز نجیب میرسند.
تعریف پیوند کووالانسی
یک جفت الکترون مشترک بین دو هسته یک پیوند کووالانسی تشکیل میدهند.
استحکام پیوند کووالانسی
آنچه اتمهای یک ملکول را به هم نگه میدارد، پیوند کووالانسی است، در تشکیل پیوند کووالانسی الکترونها، به جای آنکه از اتمی به اتم دیگر منتقل شوند، میان دو اتم به اشتراک گذاشته میشوند.استحکام پیوند کووالانسی ناشی از جاذبه متفابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است. یا به عبارت دیگر مربوط به آن است که هر دو هسته الکترون های مشترکی را جذب میکنند.

دو اوربیتال به نحوی همپوشانی میکنند که ابرهای الکترونی، در ناحیه بین دو هسته، یکدیگر را تقویت میکنند و احتمال یافتن الکترون در این ناحیه افزایش مییابد طبق اصل طرد پاولی دو الکترون این پیوند باید اسپین مخالف داشته باشند. در نتیجه تشکیل پیوند اوربیتالهای اتمی به اوربیتال مولکولی تبدیل میشود.
انواع پیوند کووالانسی
پیوند یگانه کووالانسی
متشکل از یک جفت الکترون (دارای اسپین مخالف) است که اوربیتالی از هر دو اتم پیوند شده را اشغال میکند. سادهترین نمونه اشتراک در مولکولهای دو اتمی گازهای ازقبیل F2 ، H2 و Cl2 دیده میشود. اتم هیدروژن فقط یک الکترون دارد هرگاه دو اتم هیدروژن تک الکترونهای خود را به اشتراک بگذارند یک جفت الکترون حاصل میشود.

پیوند چند گانه
بین دو اتم ممکن است بیش از یک پیوند کووالانسی تشکیل شود در این موارد گفته میشود که اتمها با پیوند چند گانه به هم متصلاند. دو جفت الکترون مشترک را پیوند دو گانه و سه جفت الکترون مشترک را پیوند سه گانه مینامند. اغلب میتوان تعداد پیوندهای جفت الکترونی را که یک اتم در یک مولکول به وجود میآورد از تعداد الکترونهای مورد نیاز برای پر شدن پوسته والانس آن اتم پیش بینی کرد.

نماد ساختار مولکول
در ساختار اول، جفت الکترون مشترک با دو نقطه و ساختار دوم با یک خط کوتاه نشان داده شده است.
مانند :
پیوند یگانه
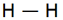
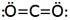
پیوند سه گانه
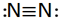


موضوعات مرتبط: مطالب علمی ، ،
برچسبها:








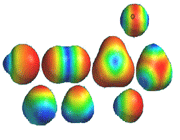


 آمار
وب سایت:
آمار
وب سایت:

